Практична робота 1 хімії 11 габрієлян. Порядок виконання роботи
вчення 11 класу
_____________________________
Лабораторні досліди
Лабораторний досвід №1Дата _________
Конструювання періодичної таблиці елементів із використанням карток.
Ціль: моделювання побудови періодичної системи
Обладнання та реактиви: 20 карток (6*10 см).
див. підручник О.С.Габрієляна Хімія 11 (базовий рівень) с.205.
Хід роботи
Висновок
Лабораторний досвід №2Дата _________
Визначення типу кристалічної решітки речовини та опис її властивостей .
Ціль: навчитися визначати тип кристалічних ґрат і описувати властивості речовин.
Обладнання та реактиви: хлорид натрію, цукор, залізо, сірка, мідь, сода, мідний купорос, графіт, нафталін, кремнезем.
Зміст та порядок виконання досвіду див. підручник О.С.Габрієляна Хімія 11 (базовий рівень) с.205 - 206.
Хід роботи:
Тип кристалічних ґрат
Речовини
Властивості речовини
Тип хімічного зв'язку
Іонна
Атомна
Молекулярна
Металева
Висновок .....................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................
Лабораторний досвід №3Дата _________
Ознайомлення з колекцією полімерів: пластмас та волокон та виробів з них.
Ціль: ознайомиться із колекцією полімерів.
Обладнання та реактиви: зразки пластмас та волокон.
Зміст та порядок виконання досвіду
Хід роботи
Полімер
Властивості полімеру
Група полімеру
Поліетилен
Поліпропілен
Полівінілхлорид
Капронове волокно
Бавовна
Вовна
Лавсан
Висновок .....................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................
Лабораторний досвід №4Дата _________
Випробовування води на жорсткість. Усунення жорсткості води.
Ціль: випробувати воду на жорсткість, навчитися усувати жорсткість води.
Обладнання та реактиви: тверда вода (розчин хлориду кальцію), розчин мила, розчин карбонату натрію, пробірки, спиртування.
Зміст та порядок виконання досвіду див. підручник О.С.Габрієляна Хімія 11 (базовий рівень) с.206.
Хід роботи
Що робили
Що спостерігали
Висновок
Висновок .....................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................
Лабораторний досвід №5Дата _________
Ознайомлення із мінеральними водами.
Ціль: ознайомлення із мінеральними водами.
Обладнання та реактиви: зразки з мінеральними водами, розчин соди, розчин кислоти, пробірки.
Зміст та порядок виконання досвіду
Хід роботи
№ п/п
Зразок
Іони, що входять до складу води
Розчин соди
Розчин кислоти
Тип води
Запишіть рівняння проведених реакцій:
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Висновок .....................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................
Лабораторний досвід №6Дата _________
Ознайомлення із дисперсними системами.
Ціль: ознайомлення із дисперсними системами.
Обладнання та реактиви: суспензії, емульсії, пасти, гелі (з фабричними етикетками)
Зміст та порядок виконання досвіду див. підручник О.С.Габрієляна Хімія 11 (базовий рівень) с.207.
Хід роботи
Назва зразка
Застосування
Термін придатності
Суспензії
Емульсії
Пасти
Гелі
Висновок .....................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................
Лабораторний досвід №7Дата _________
Реакція заміщення міді залізом у розчині мідного купоросу.
Ціль: на підставі проведеного досвіду зробити висновок про перебіг реакції заміщення.
Обладнання та реактиви: розчин мідного купоросу (сульфат міді (II)), кнопка, пробірка.
Зміст та порядок виконання досвіду див. підручник О.С.Габрієляна Хімія 11 (базовий рівень) с.207.
Хід роботи
Що робили
Що спостерігали
Висновок, рівняння реакції
Висновок .....................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................
Лабораторний досвід №8Дата _________
Реакції, що йдуть з утворенням осаду, газу та води.
Ціль: на підставі проведеного досвіду зробити висновок про перебіг реакції, що йдуть з утворенням осаду, газу та води.
Обладнання та реактиви: розчин гідроксиду натрію, розчин фенолфталеїну, розчин азотної кислоти, розчин оцтової кмслоти, розчин карбонату натрію, розчин соляної кислоти, розчин нітрату срібла, розчин мідного купоросу (сульфат міді (II)), розчин сірчаної кислоти, розчин хлориду барію, пробірки.
Зміст та порядок виконання досвіду див. підручник О.С.Габрієляна Хімія 11 (базовий рівень) с.208.
Хід роботи
Що робили
Що спостерігали
Висновок, рівняння реакції
Висновок .....................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................
Лабораторний досвід №9Дата _________
Отримання кисню розкладанням пероксиду водню за допомогою оксиду марганцю ( IV ) та каталази сирої картоплі.
Ціль: навчитися одержувати кисень.
Обладнання та реактиви: IV), сира картопля, пробірки.
Зміст та порядок виконання досвіду див. підручник О.С.Габрієляна Хімія 11 (базовий рівень) с.208 - 209.
Хід роботи
Що робили
Що спостерігали
Висновок
Висновок .....................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................
Лабораторний досвід №10Дата _________
Одержання водню взаємодією кислоти із цинком.
Ціль: навчитися одержувати водень.
Обладнання та реактиви: розчин соляної кислоти, розчин оцтової кислоти, цинк (гранули), пробірки.
Зміст та порядок виконання досвіду
Хід роботи
Що робили
Що спостерігали
Висновок
Висновок .....................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................
Лабораторний досвід №11Дата _________
Різні випадки гідролізу солей.
Ціль: розглянути різні випадки гідролізу.
Обладнання та реактиви: розчин карбонату натрію, розчин цинку хлориду, розчин нітрату калію, універсальний індикаторний папірець, пробірки.
Зміст та порядок виконання досвіду див. підручник О.С.Габрієляна Хімія 11 (базовий рівень) с.209.
Хід роботи
Розчин речовини
Індикатор
Висновок, рівняння реакцій
Висновок .....................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................
Лабораторний досвід №12Дата _________
Випробування розчинів кислот, основ та солей індикаторами.
Ціль: випробування розчинів кислот, основ, солей індикаторами.
Обладнання та реактиви: розчин гідроксиду натрію, розчин сірчаної кислоти, розчин карбонату калію, розчин хлориду алюмінію, розчин сульфату натрію, універсальний індикаторний папірець, пробірки.
Зміст та порядок виконання досвіду див. підручник О.С.Габрієляна Хімія 11 (базовий рівень) с.209.
Хід роботи
Розчин речовини
Індикатор
Висновок, рівняння реакцій
Висновок .....................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................
Лабораторний досвід №13Дата _________
Взаємодія соляної кислоти та розчину оцтової кислоти з металами.
Ціль: на підставі проведених дослідів зробити висновок про умови взаємодії кислот із металами.
Обладнання та реактиви: розчин соляної кислоти, розчин оцтової кислоти, цинк (гранули), мідний дріт, пробірки.
Зміст та порядок виконання досвіду
Хід роботи
Що робили
Що спостерігали
Висновок, рівняння реакцій
Висновок .....................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................
Лабораторний досвід №14Дата _________
Взаємодія соляної кислоти та розчину оцтової кислоти з основами.
Ціль: на підставі проведених дослідів зробити висновок про умови взаємодії кислот із основами.
Обладнання та реактиви: розчин гідроксиду натрію, розчин фенолфталеїну, розчини соляної та оцтової кислоти, пробірки.
Зміст та порядок виконання досвіду див. підручник О.С.Габрієляна Хімія 11 (базовий рівень) с.210.
Хід роботи
Що робили
Що спостерігали
Висновок, рівняння реакцій
Висновок .....................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................
Лабораторний досвід №15Дата _________
Взаємодія соляної кислоти та розчину оцтової кислоти з солями.
Ціль: на підставі проведених дослідів зробити висновок про умови взаємодії кислот із солями.
Обладнання та реактиви: розчин карбонату калію, розчин силікату калію, розчин соляної кислоти, розчин оцтової кислоти, пробірки.
Зміст та порядок виконання досвіду
Хід роботи
Що робили
Що спостерігали
Висновок, рівняння реакцій
Висновок .....................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................
Лабораторний досвід №16Дата _________
Отримання та властивості нерозчинних основ.
Ціль: вивчити спосіб отримання нерозчинних основ та його властивості.
Обладнання та реактиви: розчин сульфату міді (II), розчин гідроксиду натрію, розчин сірчаної кислоти, пробірки, спиртування.
Зміст та порядок виконання досвіду див. підручник О.С.Габрієляна Хімія 11 (базовий рівень) с.210 - 211.
Хід роботи
Що робили
Що спостерігали
Висновок, рівняння реакцій
Висновок .....................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................
Лабораторний досвід №17Дата _________
Гідроліз хлоридів та ацетатів лужних металів.
Ціль: розглянути гідроліз хлоридів та ацетатів лужних металів.
Обладнання та реактиви: розчин хлориду калію, розчин ацетату калію, універсальний індикаторний папірець, пробірки.
Зміст та порядок виконання досвіду див. підручник О.С.Габрієляна Хімія 11 (базовий рівень) с. 211.
Хід роботи
Що робили
Що спостерігали
Висновок, рівняння реакцій
Висновок .....................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................
Лабораторний досвід №17Дата _________
Ознайомлення з колекціями металів, неметалів, кислот, основ, мінералів та біологічних матеріалів, що містять деякі солі.
Ціль: ознайомлення з колекціями металів, неметалів, кислот, основ, мінералів та біологічних матеріалів.
Обладнання та реактиви: алюміній, мідь, цинк, свинець, сірка, графіт, лимонна кислота, оцтова кислота, сірчана кислота, гідроксид натрію, гідроксид заліза (III), гідроксид міді (II), гідроксид кальцію, мінерали (крейда, мармур, апатит, галіт, сильвініт).
Зміст та порядок виконання досвіду див. підручник О.С.Габрієляна Хімія 11 (базовий рівень) с.211 - 213.
Хід роботи
1.Заповніть таблицю:
Висновок .....................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................
2. Дайте характеристику кислоті:
Кислота
Група
Характеристика
3. Дайте характеристику підставі:
Заснування
Група
Характеристика
Висновок .....................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................
4. Заповніть таблицю:
Назва мінералу
Формула та назва основної складової частини
Зовнішній вигляд
Застосування
Висновок .....................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................
Практичні роботи
Практична робота №1Дата __________
Отримання, збирання та розпізнавання газів.
Ціль :…………………………………………………………………………………………..……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Зміст та порядок виконання досвіду див. підручник О.С.Габрієляна Хімія 11 (базовий рівень) с.214-215.
Завдання 1. Отримання, збирання та розпізнавання водню.
Обладнання та реактиви: цинк (гранули), розчин соляної кислоти, пробірки, спиртування.
Хід роботи:
Що робили
Що спостерігали
Висновок, рівняння реакції
…………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Завдання 2. Отримання, збирання та розпізнавання кисню.
Обладнання та реактиви: розчин пероксиду водню, оксид марганцю (IV), пробірки, тліюча лучинка.
Хід роботи:
Що робили
Що спостерігали
Висновок, рівняння реакції
Завдання 3. Отримання, збирання та розпізнавання вуглекислого газу.
Обладнання та реактиви: мармур, розчин оцтової кислоти, вапняна вода, пробірки, тліюча лучинка, скляна трубочка.
Хід роботи:
Що робили
Що спостерігали
Висновок, рівняння реакції
Завдання 4. Отримання, збирання та розпізнавання аміаку.
Обладнання та реактиви: розчин хлориду амонію, розчин гідроксиду натрію, пробірки, спиртування, штатив, лакмусовий папірець.
Хід роботи:
Що робили
Що спостерігали
Висновок, рівняння реакцій
Завдання 5. Отримання, збирання та розпізнавання етилену.
Обладнання та реактиви: гранули поліетилену, підкислений розчин марганцівки, пробірки, трубка з газовідвідною трубкою, штатив, спиртування.
Хід роботи:
Що робили
Що спостерігали
Висновок, рівняння реакцій
Загальний висновок ………………………………………………………………………………………………. ...................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................
Позначка ___________
Практична робота № 2Дата __________
Вирішення експериментальних завдань на ідентифікацію органічних та неорганічних речовин.
Ціль :…………………………………………………………………………………………..……………………………………………………………………………………………………………………………………………………………………………………………………
Зміст та порядок виконання досвіду див. підручник О.С.Габрієляна Хімія 11 (базовий рівень) с.216.
Завдання 1.
Обладнання та реактиви: розчин хлориду натрію, розчин карбонату натрію, розчин сульфату натрію, …………………………………………………………………………………………………… ..
………………………………………………………………………………………………………………
Хід роботи:
Що робили
Що спостерігали
Висновок, рівняння реакції
Завдання 2.
Обладнання та реактиви: розчин хлориду амонію, хлориду барію, хлориду алюмінію,…………. ………………………………………………………………………………………………………………...
Хід роботи:
Що робили
Що спостерігали
Висновок, рівняння реакції
Завдання 3.
Обладнання та реактиви: розчин глюкози, розчин гліцерину, розчин білка, ……………………. ………………………………………………………………………………………………………………...
Хід роботи:
Що робили
Що спостерігали
Висновок, рівняння реакції
Завдання 4.
Обладнання та реактиви: розчин ацетату натрію, розчин нітрату амонію, розчин сульфату калію, індикаторний папірець, пробірки.
Хід роботи:
Що робили
Що спостерігали
Висновок, рівняння реакції
Висновок .....................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................
Позначка __________
Використана література:
О.С.Габрієлян «Хімія.11 кл.» базовий рівень, Москва.: Дрофа, 2012

Склала Філіппова А.В.

Практичні роботи
для 7 класу

Поради ХІМІІ-- Яги
(правила техніки безпеки)
Ось послухай-но, друже,
Викладай тобі урок,
Щоб цього разу, рідний,
Ніг ти забрати не зміг!
У мене тут цілий скарб:
Калію пермангонат,
Є і сірка, є фосфор,
Є й калію хлорат.
Компоненти точно завись,
Розітріть краще суміш.
Якщо все піде як треба
Рознесе тут усе як є!
Приготуй гримучий газ,
Сірника піднеси ту годину.
Тут реакція ланцюгова-
Раз залишишся без очей!
Лій воду в кислоту,
Сульфатну візьми, не ту!
Якщо встигнеш, то побачиш-
Бризки ляжуть за версту!
Що ж, світло тобі не миле?
Руки лугом облив?
Так протри очі руками,
І про руки ти забув!
Ось понюхай аш-два-ес-
Він завжди знімає стрес. 
Від нього протиотрута
Ще не знайшов прогрес!
Рано-вранці натщесерце
Ти покуштуй аміак. 
До сльози він пробиває,
Якщо одразу не обм'як!
Хлор понюхай, друже,
Дуже багатьом він допоміг!
Та вдихай його глибше,
Щоб видихнути, не зміг!
Багато усіляких, рецептів
Є у хімії Яги:
Хош-останешся без пальців,
Ну а хочеш без ноги!
Я скажу, онучечку, тобі:
Можна жити і без ТВ,
Хоч і погано, хоч недовго,
Але на шкоду собі

Дата «___» ___________
Практична робота № 1
Правила техніки безпеки. Прийоми поводження з лабораторним обладнанням.
__________
Мета роботи:
Вивчіть правила техніки безпеки під час роботи в хімічному кабінеті
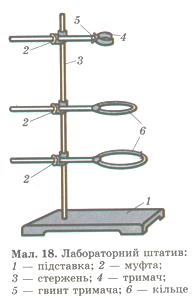
Познайомитися з різними видами хімічного посуду та можливостями його використання у хімічній лабораторії, вивчити влаштування лабораторного штатива та відпрацювати навички роботи з ним;
Обладнання:
абор хімічного посуду: пробірки, колби (конічна, плоскодонна), хімічні склянки, мірні циліндри, порцелянові чашки, тримачі для пробірок, штатив для пробірок, ложечки тощо), лабораторний штатив
ІНСТРУКЦІЯ.
Порядок виконання.
Розгляньте видані зразки хімічного посуду. Визначте призначення.
Зробіть малюнки трьох предметів хімічного посуду та поясніть, яке їхнє призначення.
Розгляньте складові лабораторного штатива, з'ясуйте їх призначення.
Зберіть штатив і закріпіть на ньому лапку, кільце.
Замалюйте зібраний штатив, вкажіть основні деталі.
Замалюйте частини горіння полум'я, вкажіть, яка частина найгарячіша.
Письменно дайте відповідь на запитання:
Якими є правила набору твердої речовини зі склянки в пробірку?
Як правильно проводити перемішування розчинів у пробірці?
8. Зробіть висновок за підсумками роботи.
Хід роботи
Завдання 1. Зразки хімічного посуду . (Замалювати та написати призначення.)
Плоскодонні колби.
Круглодонні колби.
Хімічні склянки.
Порцелянові чашки.
Мірні циліндри.

Завдання 2. Вивчити та замалювати лабораторний штатив

1) стрижень;
1 ) постачання;
2 ) муфта;
4) лапка;
5) кільце.
Завдання 3. Відповіді на запитання.
1. Тверді речовини з баночок необхідно брати тільки сухою ложечкою або сухою пробіркою?
2. Перемішування розчинів у пробірці проводять швидкими та енергійними рухами. Забороненочи
струшувати пробірку, закриваючи отвір пальцем?
Завдання 4. Будова полум'я
1.
2.
3.
4.
Висновок:
Наведіть робоче місце в порядок.
Дата "____"_____________г.
Практична робота № 2
Дослідження фізичних та хімічних явищ
Ціль:вивчити фізичні та хімічні властивості запропонованих речовин, використовуючи різні методи.
Хідроботи
Розгляньте видані зразки різних речовин.
Досліджуйте розчинність твердих речовин. Знайдіть у довідковій таблиці дані про щільність, температуру кипіння, плавлення. Результати проведеного дослідження внесіть до таблиці.
2. Дослідіть хімічні властивості цинку.
Взаємодія з водою
Взаємодія із соляною кислотою HCl
Взаємодія з хлоридом міді CuCl 2
Випаде ніє облогка у результате хі мі годеск ой реакції
Налийте в пробірку натрій сульфіт і барій хлорид. Спостереження внесіть до таблиці.
Уы ді льоніє газообразних речовин в результате хі мі годєських реакці й.
Гасіння соди.
Невелику кількість соди помістіть у пробірку і прилийте краплями розчин оцтової кислоти.
Як треба поводитися з кислотою?
Що потрібно зробити, якщо кислота потрапила на руки?
Спостереження внесіть до таблиці.
Дослідження фі зичєських процесзі впід час розчинення
Налийте в пробірку 1 мл води, додайте шпателем приблизно 1 г солі і розмішайте скляною паличкою. Що спостерігаєте? Підігрійте. Спостереження запишіть у таблицю.
Результати проведеного дослідження внесіть до таблиці:
Висновок:За допомогою яких методів ви вивчали речовини під час практичної роботи?
Як визначити газ із запаху?
А) нахилитися над судиною та вдихнути
Б) направити пари газу до себе та зробити обережний вдих
В) не знаю

А) при нахилі етикетка виявилася зверху, у долоні
Б) етикетка знаходиться знизу
В) немає значення, як взяти склянку для реактивів.
При розливі рідини на столі необхідно:
А) повідомити вчителя чи лаборанта
Б) самостійно прибрати розлиту речовину
В) вдати, що нічого не трапилося.
Чому не можна збирати на робочому місці багато реактивів?
А) можна переплутати реактиви
Б) створюється безладдя
В) можна забруднити лабораторний зошит
Г) все вище перераховане
Чому не можна пробірку з розчином нагрівати в одному місці:
А) довго не закипить
Б) може статися викид рідини та як наслідок опік руки
В) погано нагрівається
г) не знаю
Довідкова таблиця
Дата "____"_____________г.
Практична робота №2
Дослідження фізичних та хімічних явищ
Ціль:ознайомитися з характерними ознаками фізичних та хімічних явищ, навчитися їх виявляти; спостерігати фізичні та хімічні явища, описувати спостереження, робити висновки.
Обладнання:пробірки, сухе пальне, металевий штатив, скляна паличка, газовідвідна трубка.
Реактиви:мідний купорос, залізна кнопка, скріпка, цвях, харчова сода, розчин вапна.
Хід роботи
| Схема реакції: залізо + мідний купорос = мідь + ферум (11) сульфат |
||||
| Схема реакції: |
||||
| Схема реакції: |
||||
| Нагрійте воду до температури 100 градусів | ||||

Висновок:
Фізичне явище-це ____________________________________
Хімічне явище-це ____________________________________
Дата "____"_____________г.
Практична робота №3
Добування кислорода в лабораторії та вивчення його властивостей
Мета: ознайомитися із лабораторним способом добування кислорода шляхом розкладання калій перманганату, навчитися користуватися приладом для добування кислорода, навчитися збирати кисень методом витіснення повітря та витіснення води, вивчити фізичні та хімічні властивості кислорода.
Обладнання: лабораторний штатив, пробірка з газовідвідною трубкою, хімічна склянка, циліндр, скляні пластинки, конічна колба, ложечка для спалювання речовин, щипці тигельні, кристалізатор з водою, вата, скіпка.
Реактиви:кристалічний калій перманганат, известкова вода, вуглинка, сірка, перекис водороду.

Хід роботи
Завдання вчителя:
Кисень отримують з (назвати 3 речовини) _________________
Збирають кисень (вказати метод)________________________
Розпізнають кисень ____________________________________
Чи можна тримати догори дном посуд, в який збирають кисень? Відповідь обґрунтуйте.
Чи буває рідкий кисень? Відповідь поясніть.
Яка відносна молекулярна вага Озону та Кисню?
Загальний висновок:
Для кисню характерні такі властивості
Завдання вчителя (на додаткових 11 балів)
20г. Сульфур (VI) оксиду містить 12г. Сульфура та 8г. Оксигену. Які масові частки елементів у поєднанні?


Практичні роботи
для 8 класу

Правила техніки безпеки
Щоб не наражати своє життя на небезпеку,
Потрібно знати техніку безпеки: 
Робиш тільки те, що належить,
І при цьому дуже обережно.
Спочатку завдання виріши теоретично,
Потім виконуй її практично.
У хімічній лабораторії не можна ніколи
Голими руками брати речовини.
Насипаєш (наливаєш) речовини акуратно,
Чи не висипаєш (не виливаєш) речовини назад.
З хімічними речовинами будь скупим -
Їх кількістю користуйся невеликою.
Досліди робиш ретельно
Над столом (лотком) обов'язково.
Не можна вдихати пари та гази,
Якщо ти без протигазу.
Речовини в лабораторії на смак не вивчаються.
Це суворо забороняється.
Не можна змішувати чи зливати
Усі хімічні речовини поспіль.
З їдкими речовинами (кислоти, луги) працювати можна,
Але вкрай обережно.
Якщо кислоти чи луги на тебе потрапляють,
Їх великою кількістю води негайно змивають.
Кислоту у воду додають –
Тільки так кислоту розбавляють.
Якщо рідина займається легко,
Працюєш із нею від вогню далеко.
З нагрівальними приладами
Працюй дуже уважно.
На робочому місці – порядок та чистота,
Правило це виконуєш завжди.
Дата "____"_____________г.
Практична робота № 1
Дослідження властивостей основних класів неорганічних сполук

Ціль: виконати деякі реакції характерні для кислот, основ, оксидів та солей, дослідити деякі якісні реакції на неорганічні сполуки.
Обладнання: сухе пальне, пробірки, штатив, пробіркотримач.
Реактиви: індикатори, хлоридна кислота, натрій гідроксид, сульфіт натрій, барій хлорид, натрій карбонат, залізний і мідний дріт, купрум (2) оксид – порошок.
Хід роботи
Загальний у висновок:
Які властивості речовин вивчили? Які ознаки реакції спостерігали
? Реакцію яких типів ви здійснювали, виконуючи практичну роботу?
Чи станеться реакція у досвіді 2, якщо замість цинку взяти: а) магній; б) срібло? Відповідь аргументуйте.
Чи станеться реакція у досліді 5, якщо сіль замінити: а) кальцій карбонатом; б) натрій нітратом? Відповідь аргументуйте.
У непідписаних пробірках міститься розчин хлориду натрій і розведена хлоридна кислота. Запропонуйте щонайменше два способи розпізнавання цих рідин.
Якщо налив у пробірку надлишок розчинів реактивів треба:
А) злити назад
Б) злити в каналізацію
В) повідомити вчителя або лаборанта
Тверді речовини
А) беруть руками
Б) беруть шпателем
В) беруть ложечкою
Г) беруть усім вище перерахованим
При попаданні на шкіру розчину кислоти треба:
а) змити холодною водою
Б) змити холодною водою, обробити 2% розчином соди
Кислоту розбавляють:
А) наливаючи воду у кислоту
Б) наливаючи кислоту у воду
г) не знаю
В) порядок змішування не має значення
Ознака реакції:
А) зміна об'єму рідини
Б) випадання осаду
Нагріваючи пробірку її необхідно тримати так, щоб отвір було направлено
Б) убік від себе
Г) убік від себе та від сусідів

Дата "____"_____________г.
Практична робота № 2
З технікою безпеки знайомий (а) _________________
Хідроботи
У двох склянках без етикеток є розчини: в одній – соляна кислота, у другій – гідроксид натрію. Як досвідченим шляхом довести, в якій склянці є кожна речовина?
Хімічно відмийте пробірку, забруднену на практичному занятті гідроксидом заліза (III )
Доведіть, що видана речовина – хлоридна кислота.
З наявних на столі реактивів отримайте кількома способами сульфат міді (II )
(вирішіть кілька завдань за вказівкою вчителя)
Результати експерименту оформіть довільної форми, відзначте спостереження, запишіть рівняння реакцій.
Тест з правил техніки безпеки

а) це естетично
Г) не має значення
Чому надлишок речовини (реактиву) не можна зливати (зсипати) назад у склянку?
А) можна переплутати речовини
Б) забруднити речовину
В) забруднити руки
Г) важко відкрити пробки
А) не дозволяється
Б) можна за згодою вчителя
При попаданні на шкіру розчину кислоти треба:
В) обробити 2% розчином оцтової кислоти
А) на окремому листочку
В) у робочому зошиту

А) на середині пробірки
Б) біля отвору пробірки
В) у нижній частині пробірки
Г) не має значення
Висновок:
Дата "____"_____________г.
Практична робота № 2
«Рішення експериментальних завдань на тему «Основні класи неорганічних сполук»
Мета: повторити властивості оксидів, кислот, основ та солей та застосувати ці знання при експериментальному вирішенні завдань; навчитися розпізнавати речовини, вміщені у склянках без етикеток.
З технікою безпеки знайомий (а) _________________
Хідроботи
Завдання №1. Розв'яжи «Ланцюжок перетворення», записавши при цьому правильно формули речовин, враховуючи валентність хімічних елементів і кислотних залишків.
MgO Mg Cl _ Mg C O _ Mg Cl _ Mg _ (P O _)_.
Вихідні речовини, реактиви та обладнання: магній оксид, хлоридна кислота, розчини: хлорид натрій, натрій карбонат, ортофосфорна кислота; штатив із пробірками.
Завдання №2. «Долина іонів». Напиши формули іонів, які входять до складу таких речовин: магній нітрат, магній карбонат, магній ортофосфат, магній хлорид, використовуючи при цьому хімічні символи.
Увага! Для отримання необхідного результату під час проведення реакцій обміну додайте розчини реагентів по краплях, уникаючи надлишку. Так можна запобігти побічним реакціям між реагентами, який використовується в даному досвіді, і надлишком реактиву з попереднього досвіду.
Завдання №3. «Знайди реактив». У таблицю записуй формули реактивів для здійснення послідовних перетворень:
Завдання № 4. "Оформлялки". Здійсни практичні реакції виходячи із завдання № 1, свої дії, спостереження, висновки та рівняння реакції записуй у таблицю:
| Досвід 1. Здійсни перетворенняMgO Mg Cl _ |
||
| Рівняння реакції:… Це реакція - ... (вказати тип реакції) |
||
| Досвід 2. Здійснення перетворенняMg Cl _ Mg C O _ |
||
| Рівняння реакції: … Рівняння побічної реакції: …. Це реакція - ... (вказати тип реакції) |
||
| Досвід 3. Здійснення перетворенняMg C O _ Mg Cl _ |
||
| Рівняння реакції: … Це реакція - ... (вказати тип реакції) |
||
| Досвід 4. Здійснення перетворенняMg Cl _ Mg _ (P O _)_. |
||
| Рівняння реакції: … Це реакція - ... (вказати тип реакції) |
||
| Загальний висновок:під час практичної роботи я… |
Тест з правил техніки безпеки

а) це естетично
Б) наявність бруду може зашкодити проведенні експерименту
В) колір осаду може змінитися
Г) не має значення
Чому надлишок речовини (реактиву) не можна зливати (зсипати) назад у склянку?
Чому надлишок речовини (реактиву) не можна зливати (зсипати) назад у склянку?
А) можна переплутати речовини
Б) забруднити речовину
В) забруднити руки
Г) важко відкрити пробки
Проводити досліди, не передбачені інструкцією:
А) не дозволяється
Б) можна за згодою вчителя
В) можна, якщо знаєш, що вийде
При попаданні на шкіру розчину лугу необхідно:
При попаданні на шкіру розчину кислоти треба:
Б) обробити 2% розчином соди
В) обробити 2% розчином оцтової кислоти
Як оформлюються результати практичної роботи:
А) на окремому листочку
Б) у зошиті для практичних робіт
В) у робочому зошиту
Пробірку в пробіркотримачі закріплюють
А) на середині пробірки 
Б) біля отвору пробірки
В) у нижній частині пробірки
Г) не має значення

Практичні роботи
для 9 класу







Дата «___» ___________
Практична робота №1
Приготування розчину з певною масовою
часткою розчиненої речовини
Ціль:закріпити знання та навички у вирішенні розрахункових завдань; формування умінь готувати розчини з певною масовою часткою розчиненої речовини; формування практичних навичок у роботі з вимірювальними приладами.
Обладнання:хімічні склянки об'ємом 500 мл, скляна паличка з гумовим наконечником, ваги з різновагами, лопатка, мірна склянка.
Реактиви:сіль, вода (холодна та гаряча).
Хід роботи

Чому розчинення солі відбувається швидше у гарячій воді, ніж у холодній?
Чому морська вода кипить при вищій температурі, ніж дистильована вода?
Висновок:для приготовлення __________ г розчину _________ з масовою часткою солі _______% необхідно__________________________________
Контрольні питання
Чому розчинення солі відбувається краще у гарячій воді, ніж у холодній?
Чому розчинення називають фізико-хімічним процесом?
Яка вода закипить швидше: морська чи дистильована?

Дата «___» ___________
ПРАКТИЧНА РОБОТА № 2
«РЕАКЦІЇ ОБМІНУ МІЖ РОЗЧИНАМИ ЕЛЕКТРОЛІТІВ»

Ціль: вивчити практично умови, за яких можливі реакції іонного обміну між розчинами електролітів.
Обладнання: штатив із пробірками
Реактиви: розчини NaOH, HCl, CuSO 4, BaCl 2 ,Na 2 CO 3 , Na 2 SO 3 , фенолфталеїн.
Інструктаж з правил безпеки :
Акуратно брати розчини у необхідних кількостях речовин.
Особливу обережність виявляти при роботі з розчинами кислот НСl і лугу,
NaOH
Дбайливо поводитися зі скляним посудом.
Хід роботи
Загальний висновок:
Електроліти-це_________________________________________ до них відносяться___________________________________________________________
Іонні реакції-реакції____________________________________________
Реакції іонного обміну в розчинах електролітів протікають до кінця таких випадках:_____________________________________________________________


Дата «___» ___________
ПРАКТИЧНА РОБОТА № 3
Розв'язання експериментальних завдань
Ціль : навчитися практично вирішувати експериментальні завдання, послідовно отримувати неорганічні речовини (нерозчинний гідроксид, оксид тощо.), розпізнавати неорганічні речовини з їхньої хімічним властивостям.
Обладнання та реактиви: пробірки, пробіркотримач, сухе пальне, штатив для пробірок, сірники; купрум сульфат, барій хлорид, натрій карбонат, сульфіт натрій, хлоридна кислота, натрій гідроксид або калій гідроксид, індикатори.
Хід роботи
За виконання роботи користуйтеся таблицею розчинності речовин, таблицею визначенням іонів.
Досвід №1. Послідовне отримання неорганічних речовин.
Практично здійснити такі перетворення: купрум (2) сульфат – купрум (2) гідроксид-купрум (2) оксид – купрум хлорид.
Виконання завдання розбийте на етапи.
Загальний висновок: ми навчилися під час виконання дослідів.
Додаткове завдання – експериментальне завдання.
Видано розчин солі ферум (3) хлориду. Доведіть експериментально, що до складу солі входять катіони феруму та аніони хлору. Напишіть рівняння реакції у іонних формах.

Дата «___» ___________
ПРАКТИЧНА РОБОТА № 4
Властивості оцтової кислоти
Ціль: вивчити та експериментально підтвердити властивості оцтової кислоти
Реактиви: стружка або порошок магнію або цинку, натрій кристалічний карбонат (сода), розчини: оцтова кислота, ферум (3) хлорид, індикатори, натрій гідроксид.
Обладнання: пробірки, штатив для пробірок, ложка для сухої речовини.
Увага!


Хід роботи
Загальний висновок:
« Репортаж із місця події»
Сьогодні на уроці я дізнався…
Я здивувався …
Тепер я вмію...
Я хотів би …
Завдання «Відповідай – ка»
1. Які властивості неорганічних кислот має оцтова кислота?
2. Які з карбонових кислот ви використовуєте у нашому житті? Їхня фізіологічна дія на організм.
Завдання «Виправляй - ка»
Виправте помилки та розставте коефіцієнти

Дата «___» ___________
ПРАКТИЧНА РОБОТА № 5
Розв'язання експериментальних завдань з органічної хімії
Ціль: закріпити знання про органічні сполуки та навчитися експериментально підтверджувати та визначати речовини за допомогою якісних реакцій.
Обладнання:штатив із пробірками, сухе пальне, хімічна склянка, скляна паличка.
Реактиви:розчин йодної настойки, лакмус, купрум (11) сульфат, розчин лугу, крохмаль, оцтова кислота, гліцерин, яєчний білок.
Хід роботи
Рівняння реакцій:
Визначення крохмалю____________________________
Визначення гліцерину___________________________
Визначення оцтової кислоти
Визначення білка________________________________
Визначення ацетату натрій________________________
Загальний у вивід:____________________________________________
Завдання– експериментальне завдання :
Доведіть експериментально, що:
А) картопля та білий хліб містять крохмаль;
Б) стигле яблуко містить глюкозу.
Складіть перелік реактивів та обладнання, які вам будуть потрібні для проведення, план дій із дослідів.

Практичні роботи
в 10 класі

Дата «___» ___________
Практична робота № 1
Одержання вуглекислого газу та вивчення його властивостей
Ціль:навчитися розпізнавати неорганічні речовини, отримувати вуглекислий газ із мармуру, працювати з кислотами, проводити якісну реакцію на карбонат – іон.
Обладнання та реактиви:пробірка, лійка, газовідвідна трубка, штатив, пінцет, хімічна склянка, мармур або крейда, хлоридна кислота, кристалічний натрій гідрогенкарбонат (сода),індикатори та ін.
Правила техніки безпеки:
Слід дотримуватись правил роботи з розчинами кислот. Не допускати попадання кислот на шкіру і слизові оболонки.
Дотримуватись правил роботи з кислотами та отруйними речовинами – хлоридом барію та нітратом срібла. Остерігатися потрапляння на шкіру та слизові оболонки.
Хід роботи
Завдання "Вірні та невірні твердження".
Твердження
1. Вуглекислий газ – це “дикий газ”.
2. У морях і океанах міститься у 60 разів більше вуглекислого газу, ніж у земній атмосфері.
3. Природні джерела вуглекислого газу називають мофетами.
4. На околицях Неаполя знаходиться “Собача печера”, в якій не можуть перебувати собаки.
5. У лабораторіях вуглекислий газ одержують дією сірчаної кислоти на шматки мармуру.
6. Вуглекислий газ – це газ без кольору та запаху, легший за повітря, добре розчинний у воді.
7. Твердий вуглекислий газ отримав назву "сухого льоду".
8. Вапняна вода – це розчин гідроксиду кальцію у воді.

| Загальний висновок: Карбон (IV ) оксид отримують шляхом … Карбон (IV ) оксид розпізнають за допомогою … Карбонати перетворюються на гідрогенкарбонати за таких умов: … Гідрогенкарбонати перетворюються на карбонати за таких умов: … |
Завдання вчителя. Відповісти на питання.
Чому реакції між карбонатами і кислотами називаються якісними?
Чи можна випарувати сіль гідрогенкарбонату кальцій з розчину? Чому?
Дата «___» ___________
Практична робота №2
РОЗВ'ЯЗАННЯ ЕКСПЕРИМЕНТАЛЬНИХ ЗАВДАНЬ
Мета : Розв'язати експериментальні завдання на добування, визначення та доведення властивостей речовин, застосовуючи теоретичні знання та практичні навички на практиці.
Реактиви та обладнання:
розчини ферум (II ) сульфату, хлоридної кислоти, натрій гідроксиду, кальцій гідроксиду, барій хлориду, пронумеровані тверді зразки натрій хлориду, калій хлориду та барій хлориду, твердий натрій сульфат із домішками магній сульфату що містить домішки порошкоподібного заліза. колба з колодязною водою, нагрівний прилад, пробірки, пробіркотримач, сірники.
Хід роботи
| Завдання 1 |
Експериментально встановіть, чи взаємодіє ферум (ІІ) сульфат з:
а) луком; б) міддю; в) барій хлоридом.
Розв'язання
А. У пробірку наливаємо 1 мл розчину феруму (ІІ) сульфату і додаємо 1 мл розчинної основи – натрій гідроксиду. Реакція обміну, що відбувається у пробірці, може бути виражена рівнянням:
Fe S0 4 + 2NaOH -- > Na 2 S0 4 + …
Fe 2+ + S0 4 2- + 2Na + + 2OH - -- > 2Na + + S0 4 2- + …
Fe 2+ + 2OH - -- > … Випадає облога білого кольору.
На повітрі забарвлення стає зеленуватим і далі бурим.
Б. В другу пробірку поміщаємо кілька шматочків мідної проволоки, яку попередньо очистили від оксидної плівки. Додаємо 2 мл концентрованого розчину ферум (ІІ) сульфату. Змін не спостерігаємо.
Fe S 0 4 + Cu -/- >
Мідь, як менш активний метал не відновлює залізо із розчину солі.
В. У третю пробірку наливаємо 1мл розчину феруму (ІІ) сульфату і додаємо краплями розчин барій хлориду. Спостерігаємо утворення білого дрібнокристалічного облогу:
Fe S 0 4 + B аСІ 2 -- > Fe СІ 2 + BaS 0 4 ↓
Fe 2+ + S 0 4 2 ─ + Ba 2 + + 2Cl ─ -- > Fe 2+ + 2Cl ─ + BaS 0 4 ↓
S0 4 2 ─ + Ba 2 + -- > BaS0 4 ↓
| Завдання 2 |
Доведіть, що виданий вам порошкоподібний купрум (ІІ) оксид містить домішки порошкоподібного заліза.
Розв'язання
У пробірку насипаємо трохи порошку та наллємо 2 мл розчину хлоридної кислоти. Чорний порошок купрум (ІІ) оксиду розчиняється, утворюється зелений розчин купрум (ІІ) хлориду. Для прискорення реакції вміст пробірки обережно підігріваємо: Cu 0 + 2 HCI -- > H20+CuCI2.
Газ, що виділяється, збираємо в перегорнуту дном до гори пробірку.
Підпалюючи газ чуємо характерну бавовну. Отже, цей газ – водород.
Є домішки заліза:
Fe + 2 HCI -- > FeCl 2 + H 2
0 2e 0
Fe + 2 H + + 2 CI ─ -- > Fe 2+ + 2 Cl ─ + H 2 . Прості речовини метали – відновники. Залізо розташоване у ряді активності до водороду – заміщує атоми гідрогену в кислоті. Оксиди ж металів водород не витіскують.
| Завдання 3 |
Проробіть експерименти, за допомогою яких можна встановити часову твердість води.
Розв'язання
Тимчасова жорсткість води – карбонатна, зумовлена вмістом у ній гідрогенкарбонатів кальцію та магнію. Розчинні гідрогенкарбонати виявляємо наступними дослідами. Ділимо досліджувану воду на дві частини.
Розчинні гідрогенкарбонати металів розкладаються до нерозчинних карбонатів:
Me(HCO 3 ) 2 - t o -> MeCO 3 ↓ + H 2 O + CO 2
До другої порції додаємо насичений розчин кальцій гідроксиду. Так само кисла сіль переходитиме в середню. Таких солей міститься багато, бо розчин стає мутним.
З часом відстоюється білий осад кальцій карбонату:
Ca (HCO 3) 2 + Са(ОН) 2 --> 2CaCO 3 ↓ + 2H 2 O
Ca 2+ + 2HCO 3 ─ + Са 2+ + 2ОН ─ --> 2CaCO 3 ↓ + 2H 2 O
| Завдання 4 |
Доведіть, що виданий твердий натрій сульфат містить домішки магній сульфату.
Розв'язання
Взаємодія натрій гідроксиду та чистого натрій сульфату – реакція зворотна, не йде до кінця. Видимих змін не відбувається:
Na 2 SO 4 + 2Na ВІН < -- > 2Na ВІН + Na 2 SO 4
2Na + + SO 4 2─ + 2Na + + 2ОН ─ <- -- > 2Na + + 2ОН ─ + 2Na + + SO 4 2─
Для виявлення йона Mg 2+ використовуємо реакцію утворення важкорозчинної сполуки. Магній у вигляді білого аморфного облогу Mg (ОН) 2 осаджують їдкі луги Наприклад розчин їдкого натру:
MgSO 4 + 2Na ВІН - -- > Na 2 S O 4 + Mg (ВІН) 2 ↓ .
Mg 2+ + SO 4 2 ─ + 2Na + + 2ОН ─ - -- > 2Na + + S O 4 2 ─ + Mg (ВІН) 2 ↓
Mg 2+ + 2ОН ─ - -- > Mg (ВІН) 2 ↓
При дослідженні виданої нам суміші було виявлено домішки. Розчин помутнів. Із завису відстоявся осад магній гідроксиду.
| Завдання 5 |
Розпізнайте (не вдаючись до розчинення, а скориставшись відкритим пламенем нагрівного приладу) тверді зразки натрій хлориду, калій хлориду та барій хлориду.
Розв'язання
Для кожної солі окремо необхідно підготувати очищений багаторазовим промиванням у соляній кислоті та прожарюванням дріт (бажано платиновий).
По черзі на дроті вносимо в безбарвне полум'я зразки (кілька кристаликів) солей, що видані нам під номерами. Перша сіль містить йони Натрію – у найбільш гарячій, верхній частині спостерігаємо яскраво-жовтий колір.
Жовті спалахи при другій спробі вказують також на домішки сполук натрію, тому для спостереження за пламенем скористаємося синім (кобальтовим) склом як світлофільтром. Присутність йонів Калію визначаємо за фіолетовою облямівкою.
Останній зразок солі, при розігріванні у верхній частині полум'я надає йому блідо-зеленого кольору. Робимо висновок про вміст йонів Барію в ньому.
Отже, під №_находився натрій хлорид, № _- калій хлорид, № _- барій хлорид.
Додаткове завдання.Підручник О.Г. Ярошенка – 10 клас.
Ферум, як d-елемент із незаповненими d-орбіталями, утворює комплексні сполуки. Іоні - донори електронів встановлюють з атомами феруму ковалентні зв'язки за донорно-акцепторним механізмом.
Комплексними сполуками феруму є гексаціаноферат (II) До 4 - жовта кров'яна сольі гексаціаноферат (III) калію К 3 - червона кров'яна сіль (див. також підручник стор. 186), гексатіоціаноферат (III) калію К3, тетрахлорофератна (III) кислота Н, октагідроксиферат (III) калію К3 тощо.
Під час взаємодії солей заліза (II) з гексаціанофератом (III) калію утворюється осад синього кольору. турнбулева синь:
3Fe 2+ + 2 3 ─ - => Fe 3 2 .
В результаті реакції солей Fe(III) з гексаціанофератом (II) калію також утворюється осад синього кольору - берлінська блакитна:
4Fe 3+ + 3 4─ => Fe 4 3 .
Під час взаємодії солі феруму (III) з тіоціанатом (роданідом) амонію NH 4 SCN або калію KSCN утворюється сполука темно-червоногокольору- тіоціанат (роданід) феруму (III):
FeCl 3 + 3KSCN => 3KCl + Fe (SCN) 3;
«Роданід заліза (III)»
Fe 3+ + 3SCN ─ - => Fe (SCN ) 3 .
У разі надміру тіоціанат-іонів SCN - утворюється гексатіоціаноферат (III) калію червоного кольору:
Fe (SCN) 3 + 3SCN ─ => 3─
Наведені рівняння відображають якісні реакції на іони ферум (II) та (III). Гексаціаноферат (II) калію К 4 та тіоціанати лужних металів або алюмінію є реактивами на ферум (ІІІ)-іон, гексаціаноферат (III) калію К 3 - на ферум (ІІ)-іон.
Дослідіть видані вам сполуки Феруму (ІІ) і (ІІІ), використовуючи наявні реактиви за вказаними вище якісними реакціями.
Результати дослідів занесіть до таблиці:
| Fe 2+ | Fe 3+ |

Практичні роботи
для 11 класу

Чай та смачний бутерброд 
Дуже просять у твій рот.
Не обманюйте себе -
Їсти й пити в нас не можна!
Це, друже, хімкабінет,
Для їди умов немає.
Нехай у пробірці пахне воблою,
У колбі - ніби мармелад,
Речовини на смак не пробуй!
Солодко пахне навіть отрута.
Як нюхати речовини?
У колбу носа пхати не можна!
Що може трапитись?
Ти можеш отруїтися!
Хочеш весел бути і радий -
Одягай завжди халат!
Голова раптом твоя закружляла,
Руки начебто не твої.
Якщо таке сталося,
Вчителю одразу скажи.
Всім допоможе, підбадьорить,
Наш учитель Айболіт!
Раптом потрапив тобі на шкіру
Отруйний хімікат:
Терміново змийте його водою,
А то будеш сам не радий!
Раптом залишили спиртування
У відкритому вигляді на столі.
Закрий її без зволікання,
А то згориш ти на вогні!
Мій свій посуд чисто
Після дослідів завжди,
та інші дітлахи
Чи не засудять ніколи.
Нюхати треба обережно,
І при тому, махнувши рукою,
І тоді не буде погано
У дитини із головою.
Якщо на руку потрапила
Крапля рідини який,
Поспіши промити те місце
Ти холодною водою!
Перш ніж почати працювати,
Парту треба розчищати,
А то підручник буде
Під рукою тобі заважати!
Увійшовши до хімічного нашого кабінету, 
Не порушуй вчителів порада:
І якщо навіть ти не боягуз,
Не пробуй речовини на смак!
І нюхати їх не думай ти.
Зрозумій, що то не квіти!
Ніщо руками не бери,
Опік отримаєш, пухирі!
Посуд брудну помою,
Ну, а потім йди додому!
Ми працюємо по парах,
Щоб не обдало жаром,
Ти пробірку відверни
Від сусіда попереду.
Всю спочатку прогрівай,
Куточком нахиляй,
А потім – сильніше там,
Де є місце речовин!
Ми розчинник підігріли,
Речовини у нас скипіли.
Треба полум'я приборкати
І спиртовочку закрити!
Залишки зливу без дозволу,
Ти не отримаєш втіхи.
Реакція початися може,
Тоді ніхто не допоможе.
Рукою не чіпай реактиви –
Почнуться страшні нариви.
А якщо торкнешся кислоти,
О, скоро ти пошкодуєш!
У кабінеті хімії
Багато всяких штучок:
Колбочки, пробірки,
Вирва та штатив.
І тягнути не потрібно
Даремно ручок,
А то проллєш випадково
Цінний реактив!
Дата «___» ___________
Практична ро бота №1
Видалення забруднень органічного походження з поверхні тканини.
Мета:показати вміння застосовувати теоретичні знання на практиці та рівень практичних навичок під час виконання хімічного експерименту; навчитись видаляти загрязнення органічного походження з поверхні тканини; повторити правила техніки безпеки
Реактиви та обладнання:клаптики тканини із загрязненнями різного органічного походження; розчини: рідина для зняття лаку, етанол, нашатирний спирт, гліцерол;, мило, синтетичний мийний засіб; крохмаль, пробірки, пробірко тримач, нагрівальний прилад, сірники, вата, фаянсові чашки, хімічні склянки, фільтрувальний папір.
Хід роботи
Варіант І
Завдання 1. Удалите пятно від лаку для нігтів.
Завдання 2. Удалите пятно від вершкового масла.
Завдання 3. Удалите пятно від пащі кулькової ручки.
Завдання 4. Видалити пляму від трави.
Висновок
Спосіб видалення пятна залежить від кількох факторів: типу загрязнюючої речовини, типу тканини, давності загрязнення. Свіжі плями, особливо рослинного походження, можна видаляти із меншими усилиями. Але всі плями від загрязнення органічними сполуками можна вивести за допомогою органічних розчинників, дотримуючись правил техніки безпеки.
Варіант ІІ
Завдання 1. Видалити пятно від губної помади.
Завдання 2. Удалите пятно від шоколаду.
Завдання 3. Удалите від соку чорної смородини.
Завдання 4. Видалити пятно від чаю.
Висновок
Спосіб видалення пятна залежить від кількох факторів: типу загрязнюючої речовини, типу тканини, давності загрязнення. Свіжі плями, особливо рослинного походження, можна видалити з меншими зусиллями. Але всі плями від загрязнення органічними сполуками можна вилучити органічними розчинниками, дотримуючись правил техніки безпеки.




Практичні роботи з хімії
8 клас
Практична робота №1 «Прийоми поводження з лабораторним обладнанням»
Інструктаж з техніки безпеки.
Лабораторне обладнання
1. Пристрій та принцип роботи лабораторного штатива (намалювати штатив, позначити його складові)
2. Пристрій та принцип роботи спиртування (намалювати спиртування, позначити його складові)
3.Посуд (намалювати пробірки, колби, хімічну склянку)
4.Фільтрування:
1. приготувати фільтрувальний папір;
2. змочити фільтрувальний папір;
3. вкласти у вирву;
4. рідину наливають, по скляній паличці, спрямовуючи її на стінку вирви;
5. фільтрат, стікає по стінці склянки, а не в центр, щоб не виплескувався.
Знайти у тексті визначення фільтрату, осаду та процесу фільтрування.
Практична робота № 2«Спостереження за свічкою, що горить»
Досвід 1 . Фізичні явища при горінні свічки
Засвітіть свічку. Ви побачите, як починає танути парафін біля ґнота, утворюючи круглу калюжку. Який процес (фізичний чи хімічний) тут має місце?
Візьміть щипцями тигельними зігнуту під прямим кутом скляну трубку, один кінець її внесіть в середню частину полум'я, а інший опустіть в пробірку. Що ви спостерігаєте?
1. Парафін тане. Це плавлення – фізичний процес.
2. Стінки пробірки пітніють – це конденсація – фізичний процес.
Досвід 2 . Виявлення продуктів горіння в полум'ї
Візьміть тигельними щипцями шматочок жерсті (2x2 см) від консервної банки або предметне скло, внесіть у зону темного конуса свічки, що горить, і потримайте 3-5 с. Швидко підніміть жерсть (скло), подивіться на нижню площину. Поясніть, що з'явилося.
Суху пробірку закріпіть у тримачі, переверніть дном догори і потримайте над полум'ям до запотівання. Поясніть явище, що спостерігається.
У ту ж пробірку швидко налийте 2-3 мл вапняної води. Що спостерігаєте? Дайте пояснення.
1. З'явилася темна (чорна) пляма - це сажа (вуглець), що утворився при горінні парафіну.
2. На стінках пробірки конденсується волога. Це конденсується вода, один із продуктів горіння парафіну.
3. При приливанні пробірку вапняної води вона каламутніє:
Це свідчить, що другим продуктом горіння парафіну є вуглекислий газ.
Досвід 3 . Вплив повітря на горіння свічки
Вставте скляну трубку з відтягнутим кінцем у гумову грушу, стискаючи її рукою, продуйте в полум'я свічки повітря. Як змінилася яскравість полум'я?
Прикріпіть дві свічки за допомогою розплавленого парафіну до картону (фанера, оргаліт). Засвітіть їх і накрийте одну півлітровою банкою, іншу – дволітровою (можна взяти хімічні склянки різної місткості). У якому разі свічка горить довше? Чому?
Запишіть рівняння реакцій горіння, якщо речовини, з яких складається свічка, мають формули С 16 Н 34 і 17 H 36 .
1. Яскравість полум'я збільшилася, оскільки збільшився потік кисню.
2. Свічка у більшій банці горить довше, тому що в ній більше кисню.
Практична робота № 3«Аналіз ґрунту та води»
Досвід 1. Механічний аналіз ґрунту
У пробірку помістіть ґрунт (стовпчик ґрунту має бути 2-3 см). Прилийте дистильовану воду, об'єм якої повинен бути в 3 рази більший за об'єм грунту.
Закрийте пробкою пробірку і ретельно струшуйте 1-2 хв, а потім озброїться лупою і спостерігайте за осадженням частинок грунту і структурою опадів. Опишіть та поясніть свої спостереження.
Спочатку осідатимуть більші та важкі частинки піску та глини, потім дрібніші, але розчин ще дуже довго буде каламутним – найдрібніші частинки знаходяться у зваженому стані.
Досвід 2. Отримання ґрунтового розчину та досліди з ним
Приготуйте паперовий фільтр, вставте його у вирву, закріплену в кільці штатива. Підставте під вирву чисту суху пробірку і профільтруйте отриману в першому досвіді суміш ґрунту та води. Перед фільтруванням суміш не слід струшувати. Грунт залишиться на фільтрі, а зібраний у пробірці фільтрат є ґрунтовою витяжкою (ґрунтовий розчин).
Декілька крапель цього розчину помістіть на скляну пластинку і за допомогою пінцету потримайте її над пальником до випаровування води. Що спостерігаєте? Поясніть.
Візьміть два лакмусові папірці (червоний і синій), нанесіть на них скляною паличкою ґрунтовий розчин. Зробіть висновок щодо результатів своїх спостережень.
1. Після випаровування води на склі залишиться білий наліт, це суміш речовин, що розчинилися у воді під час перемішування.
2. Універсальний лакмусовий папірець не змінить свій колір якщо розчин нейтральний, стане червоним, якщо він кислий, і синім якщо він лужним.
Досвід 3. Визначення прозорості води
Для досвіду потрібен прозорий скляний плоскодонний циліндр діаметром 2-2,5 см, висотою 30-35 см Можна використовувати мірний циліндр на 250 мл без пластмасової підставки.
Рекомендується провести досвід спочатку з дистильованою водою, а потім із водою з водойми і порівняти результати. Встановіть циліндр на друкований текст і вливайте воду, що досліджується, стежачи за тим, щоб можна було читати через воду текст. Позначте, на якій висоті ви не бачитимете шрифт. Виміряйте висоти стовпів води лінійкою. Зробіть висновки.
Виміряна висота називається рівнем видимості.
Якщо рівень видимості малий, значить водоймище сильно забруднене.
Досвід 4. Визначення інтенсивності запаху води
Конічну колбу наповніть на 2
/
3
об'єму досліджуваної водою, щільно закрийте пробкою (бажано скляною) і сильно струсіть. Потім відкрийте колбу та відзначте характер та інтенсивність запаху. Дайте оцінку інтенсивності запаху води у балах, користуючись таблицею 8.
Скористайся таблицею № 8 (стор. 183).
Практична робота № 4"Ознаки хімічних реакцій"
Досвід 1. Прожарювання мідного дроту та взаємодія оксиду міді (II) із сірчаною кислотою
Спаліть спиртовку. Візьміть тигельними щипцями мідний дріт і внесіть його в полум'я. Через деякий час вийміть дріт із полум'я і зчистіть з нього чорний наліт, що утворився, на аркуш паперу. Досвід повторіть кілька разів. Помістіть отриманий чорний наліт у пробірку і прилийте розчин сірчаної кислоти. Підігрійте суміш. Що спостерігаєте?
Чи утворилася нова речовина під час розжарювання міді? Запишіть рівняння хімічної реакції та визначте її тип за ознакою числа та складу вихідних речовин та продуктів реакції. Які ознаки хімічної реакції ви спостерігали? Чи утворилася нова речовина при взаємодії оксиду міді (II) із сірчаною кислотою? Визначте тип реакції за ознакою числа та складу вихідних речовин та продуктів реакції та запишіть її рівняння.
1. При прожарюванні мідного дроту мідь окисляться та утворюється чорний оксид міді (II). Це реакція сполуки.
2. Оксид міді (II), що утворився, розчиняється в сірчаній кислоті, розчин стає блакитного кольору, утворюється сульфат міді (II):
Це реакція обміну.
Досвід 2. Взаємодія мармуру із кислотою
Покладіть у невелику склянку 1-2 шматочки мармуру. Прилийте в склянку стільки соляної кислоти, щоб нею вкрилися шматочки. Запаліть лучинку і внесіть її в склянку.
Чи утворилися нові речовини під час взаємодії мармуру з кислотою? Які ознаки хімічних реакцій ви спостерігали? Запишіть рівняння хімічної реакції та вкажіть її тип за ознакою числа та складу вихідних речовин та продуктів реакції.
1. Мармур розчинився в соляній кислоті, відбулася хімічна реакція:
Досвід 3. Взаємодія хлориду заліза (III) з роданідом калію
У пробірку налийте 2 мл розчину хлориду заліза (III), а потім кілька крапель розчину роданіду калію KSCN - солі кислоти HSCN з кислотним залишком SCN-
.
Якими ознаками супроводжується ця реакція? Запишіть її рівняння та тип реакції за ознакою числа та складу вихідних речовин та продуктів реакції.
Розчин став яскраво-червоним, утворився роданід заліза (III).Це реакція обміну.
Досвід 4. Взаємодія карбонату натрію із хлоридом кальцію
У пробірку налийте 2 мл карбонату розчину натрію. Потім додайте кілька крапель розчину кальцію хлориду. Що спостерігаєте? Запишіть рівняння хімічної реакції та вкажіть її тип за ознакою числа та складу вихідних речовин та продуктів реакції.
Спостерігається виділення білого кристалічного осаду барію сульфату. Це реакція обміну.
Практична робота № 5«Приготування розчину цукру та визначення масової частки його в розчині»
Відміряйте мірним циліндром 50 мл дистильованої води і влийте її в конічну колбочку ємністю 100 мл.
Чайну ложку цукрового піску (або два шматочки) зважте на лабораторних вагах, потім помістіть в колбочку з водою і перемішуйте скляною паличкою до повного розчинення.
Тепер приступайте до розрахункової частини. Спочатку розрахуйте масову частку цукру у розчині. Необхідні дані у вас є: маса цукру, об'єм води, щільність води прийміть 1 г/мл.
9 клас
Практична робота №1«Здійснення ланцюжка хімічних перетворень»
Проведіть реакції, у яких здійснюються запропоновані нижче хімічні перетворення (за варіантами).
Складіть рівняння відповідних реакцій. Реакцію іонного обміну запишіть також у іонній формі.
Варіант 1.
Проведемо такі перетворення:
Варіант 2.
Варіант 3.
Варіант 3.
Практична робота № 2«Отримання та властивості з'єднань металів»
Завдання 1
У математиці діє правило - «від зміни місць доданків сума не змінюється». Чи справедливо воно для хімії? Перевірте це з прикладу наступного досвіду.
Отримайте гідроксид алюмінію за реакцією обміну та доведіть його амфотерний характер. Для цього ви можете використовувати реакцію, рівняння якої
Проведіть цю реакцію у двох варіантах, використовуючи у кожному варіанті однакові обсяги вихідних речовин: спочатку до розчину однієї з вихідних речовин (реагенту) додайте по краплях розчин іншого реагенту, потім поміняйте послідовність введення реакцію. Спостерігайте, у якому разі випаде осад, а в якому – ні.
Поясніть результати та запишіть рівняння проведених реакцій у молекулярній та іонній формах.
Завдання 2
Проведіть реакції, що підтверджують якісний склад кальцію хлориду. Запишіть рівняння реакцій у молекулярній та іонній формах.
Завдання 3
Здійсніть перетворення згідно з наступною схемою 1
:
1
Для здійснення другого перетворення використовуйте хлорну воду.
Напишіть рівняння відповідних реакцій та розгляньте їх з позицій окислення-відновлення. Проведіть якісні реакції, які б підтверджували наявність продуктів реакцій. Запишіть рівняння реакцій у молекулярній та іонній формах.
Завдання 4
Отримайте сульфат заліза (II) щонайменше трьома способами. Рівняння реакцій іонного обміну запишіть у іонній та молекулярній формах, а реакції заміщення розгляньте з позицій окислення-відновлення.
Завдання 5
Проведіть реакції, що підтверджують якісний склад сульфату заліза (ІІ). Запишіть рівняння відповідних реакцій у молекулярній та іонній формах.
Практична робота № 3«Експериментальні завдання з розпізнавання та отримання речовин»
У виданих три пробірках (варіанти 1, 2 або 3) містяться тверді речовини, а в трьох інших (варіант 4) розчини речовин.
Досвідченим шляхом визначте, в якій пробірці є кожна з виданих вам речовин. Напишіть рівняння відповідних реакцій у молекулярному та іонному видах.
Після цієї частини роботи виконайте одну-дві експериментальні завдання з наступного переліку (за вказівкою вчителя).
Варіант 1
а) гідроксид натрію;
б) карбонат калію;
в) хлорид барію.
Варіант 2
а) карбонат кальцію;
б) сульфат натрію;
в) хлорид калію.
Варіант 3
а) нітрат барію;
б) сульфат натрію;
в) карбонат кальцію.
Варіант 4
а) хлорид натрію;
б) хлорид алюмінію;
в) хлорид заліза (ІІІ).
Завдання 1. Доведіть досвідченим шляхом, що залізний купорос, зразок якого вам виданий, містить домішку сульфату заліза (III). Напишіть рівняння відповідних реакцій у молекулярному та іонному видах.
Завдання 2. Отримайте оксид заліза (III), виходячи із хлориду заліза (III). Напишіть рівняння відповідних реакцій, а рівняння реакції за участю електроліту та в іонному вигляді.
Завдання 3. Отримайте розчин натрію алюмінію, виходячи з хлориду алюмінію. Запишіть рівняння виконаних реакцій у молекулярному та іонному видах.
Завдання 4. Отримайте сульфат заліза (II), виходячи із заліза. Запишіть рівняння виконаних реакцій і розберіть окисно-відновні процеси.
Практична робота № 4Експериментальні завдання на тему «Підгрупа кисню»
Завдання 1.Проведіть реакції, що підтверджують якісний склад сірчаної кислоти. Напишіть рівняння реакцій.
Завдання 2. У пробірку помістіть 1-2 гранули цинку і прилийте до неї близько 1 мл розведеної сірчаної кислоти. Що ви спостерігаєте? Напишіть рівняння реакції та розгляньте окислювально-відновні процеси.
Завдання 3. Налийте у дві пробірки розчин сульфіду натрію. Прилийте в одну з них хлорну воду, а в іншу – бромну воду. Що ви спостерігаєте? Поясніть свої спостереження. Напишіть рівняння відповідних реакцій у молекулярному та іонному видах.
Хлорна та бромна вода – окислювачі, тому в обох пробірках сульфід окислиться до сірки. Розчини знебарвлюються.
Завдання 4. Вам видано три пробірки із розчинами. Визначте, в якій із них знаходиться соляна кислота, сірчана кислота та гідроксид натрію. Напишіть рівняння відповідних реакцій у молекулярному та іонному видах.
Завдання 5. Визначте, чи містить кухонна сіль домішка сульфатів. Напишіть рівняння реакцій у молекулярному та іонному видах.
Завдання 6. За допомогою характерних реакцій встановіть, чи є видана вам сіль сульфатом, йодидом або хлоридом. Напишіть рівняння відповідних реакцій у молекулярному та іонному видах.
Завдання 7. Виходячи з оксиду міді (II), отримайте розчин сульфату міді (II) і виділіть із нього кристалічний мідний купорос. Напишіть рівняння відповідних реакцій у молекулярному та іонному видах.
Завдання 8. Вам видано три пробірки з розчинами сульфату, сульфіту та сульфіду натрію. Визначте за допомогою лише одного реактиву, в якій пробірці є кожна речовина. Напишіть рівняння відповідних реакцій у молекулярному та іонному видах.
Практична робота № 5Експериментальні завдання на тему «Підгрупи азоту та вуглецю»
Завдання 1.Проведіть реакції, за допомогою яких можна довести, що видана вам у закритих судинах речовина є:
а) хлоридом амонію;
б) карбонатом натрію;
в) нітратом амонію;
г) нашатирним спиртом;
д) карбонатом кальцію;
е) силікатом натрію.
Завдання 2. Доведіть досвідченим шляхом, що сульфат амонію та нітрат амонію не можна змішувати з вапном перед внесенням цих добрив у ґрунт, і поясніть чому. Напишіть рівняння реакцій.
Завдання 3. Доведіть досвідченим шляхом, що:
а) до складу хлориду амонію входять іони NH 4 + і Cl -;
б) до складу сульфату амонію входять іони NH 4 + та SO 4 2- .
Напишіть рівняння проведених реакцій у молекулярному та іонному видах.
Завдання 4. Отримайте аміак з наступних солей:
а) хлориду амонію;
б) сульфату амонію;
в) нітрат амонію.
Напишіть рівняння проведених реакцій у молекулярному та іонному видах.
Завдання 5. Проведіть реакції, які виражаються скороченими іонними рівняннями.Напишіть рівняння проведених реакцій у молекулярному та іонному видах.
Завдання 6. У чотирьох пробірках вам видано кристалічні речовини: сульфат натрію, хлорид цинку, карбонат калію, силікат натрію. Визначте, яка речовина знаходиться у кожній пробірці. Складіть рівняння реакцій у молекулярному та іонному видах.
Практична робота № 6
Варіант 1.
Досвід 1. Отримання, збирання та розпізнавання водню
Зберіть прилад для отримання газів та перевірте його на герметичність. У пробірку покладіть 1-2 гранули цинку і прилийте до неї 1-2 мл соляної кислоти. Закрийте пробірку пробкою з газовідвідною трубкою (див. мал. 43) і надягніть на кінчик трубки ще одну пробірку. Зачекайте деякий час, щоб пробірка заповнилася газом, що виділяється.
Зніміть пробірку з воднем і, не перевертаючи її, піднесіть до спиртовки, що горить. Якщо водень вибухає з глухою бавовною, то він чистий, а якщо з звуком, що «гавкає», значить, водень зібраний у суміші з повітрям («гримучий газ»).
Запитання та завдання
1. Що відбувається при взаємодії цинку із соляною кислотою? Складіть рівняння реакції та дайте її характеристику за всіма вивченими ознаками класифікації хімічних реакцій.
2. Розгляньте записану реакцію з погляду процесів окислення-відновлення.
3. Опишіть фізичні властивості водню, які безпосередньо спостерігаються при проведенні досвіду.
4. Опишіть, як можна розпізнати водень.
Досвід 2. Отримання, збирання та розпізнавання аміаку
Зберіть прилад, як показано на малюнку 113, та перевірте його на герметичність.
У фарфорову чашку насипте хлорид амонію та гідроксид кальцію об'ємом по одній ложці для спалювання речовин. Суміш перемішайте скляною паличкою та висипте в суху пробірку. Закрийте її пробкою і зміцніть в лапці штатива (зверніть увагу на нахил пробірки щодо отвору!). На газовідвідну трубку надягніть суху пробірку для збирання аміаку.
Пробірку із сумішшю хлориду амонію та гідроксиду кальцію прогрійте спочатку всю (2-3 рухи полум'я), а потім у тому місці, де знаходиться суміш.
Для виявлення аміаку піднесіть до отвору перевернутої вгору дном пробірки вологий фенолфталеїновий папірець.
Припиніть нагрівання суміші. Пробірку, в якій зібрано аміак, зніміть із труби з газовідвідом. Кінець газовідвідної трубки відразу ж закрийте шматочком мокрої вати.
Негайно закрийте отвір знятої пробірки великим пальцем і опустіть у посудину з водою. Палець відніміть лише під водою. Що ви спостерігаєте? Чому вода піднялася у пробірці? Закрийте пальцем отвір пробірки під водою і вийміть з посудини. Додайте в пробірку 2-3 краплі розчину фенолфталеїну. Що спостерігаєте?
Проведіть аналогічну реакцію між розчинами лугу та солі амонію при нагріванні. Піднесіть до отвору пробірки вологий індикаторний папірець. Що спостерігаєте?
Запитання та завдання
1. Що відбувається при взаємодії хлориду амонію та гідроксиду кальцію? Складіть рівняння реакції та дайте її характеристику за всіма вивченими ознаками класифікації хімічних реакцій.
2. Опишіть фізичні властивості аміаку, які безпосередньо спостерігаються в досвіді.
3. Опишіть щонайменше два способи розпізнавання аміаку.
Варіант 2.
Досвід 1. Отримання, збирання та розпізнавання кисню
Зберіть прилад, як показано на малюнку 114, та перевірте його на герметичність. У пробірку насипте приблизно на ¼ її об'єму перманганату калію KMnO 4 і біля отвору пробірки покладіть пухку грудочку вати. Закрийте пробірку пробкою із газовідвідною трубкою. Зміцніть пробірку в лапці штатива так, щоб кінець газовідвідної трубки доходив майже до дна судини, в якій збиратиметься кисень. Наявність кисню в посудині перевірте тліючою лучинкою.
Запитання та завдання
1. Що відбувається при нагріванні перманганату калію? Складіть рівняння реакції та дайте її характеристику за всіма вивченими ознаками класифікації хімічних реакцій.
2. Розгляньте записану реакцію з погляду процесів окислення-відновлення.
3. Опишіть фізичні властивості кисню, які безпосередньо спостерігаються в досвіді.
4. Опишіть, як ви розпізнавали кисень.
Досвід 2. Отримання, збирання та розпізнавання оксиду вуглецю (IV)
У пробірку помістіть кілька шматочків крейди або мармуру і налийте 1-2 мл розведеної соляної кислоти. Швидко закрийте пробірку пробкою із газовідвідною трубкою. Кінець трубки опустіть в іншу пробірку, де знаходиться 2-3 мл вапняної води.
Декілька хвилин спостерігайте, як через вапняну воду проходять бульбашки газу.
Запитання та завдання
1. Що відбувається при взаємодії крейди чи мармуру із соляною кислотою? Складіть рівняння реакції та дайте її характеристику за всіма вивченими ознаками класифікації хімічних реакцій.
2. Розгляньте проведену реакцію у світлі теорії електролітичної дисоціації.
3. Опишіть фізичні властивості оксиду вуглецю (IV), які безпосередньо спостерігаються в досвіді.
4. Напишіть, як ви розпізнавали оксид вуглецю (IV).
Ця реакція є якісною на вуглекислий газ.
11 клас
Практична робота №1«Отримання, збирання та розпізнавання газів»
Варіант 1. Отримання, збирання та розпізнавання водню
Отримайте, зберіть, розпізнайте водень і зробіть досліди, що характеризують його властивості. Складіть рівняння відповідних реакцій.
У пробірку налили трохи соляної кислоти та опустили гранулу цинку. Пробірку закрили пробкою з газовідвідною трубкою, кінець якої опустили в іншу пробірку, перевернуту вгору дном. Спостерігаємо виділення бульбашок газу водню. Через деякий час другу пробірку перевернули і піднесли обережно палаючу скіпку. Водень згоряє, на стінках пробірки конденсується вода.
Варіант 2. Отримання, збирання та розпізнавання кисню
Отримайте, зберіть, розпізнайте кисень і зробіть досліди, що підтверджують його хімічні властивості. Запишіть рівняння відповідних реакцій.
У пробірку насипали трохи перманганату калію, усередину поклали грудочку вати та закрили її пробкою із газовідвідною трубкою. Потім зміцнили пробірку на штативі так, щоб кінець трубки доходив до дна склянки, в якій збиратиметься кисень. Нагріли пробірку, зібрали повну склянку кисню (повноту склянки перевіряємо по тліючій лучині, вона спалахує) і закрили склянку картоном.
Варіант 3. Отримання, збирання та розпізнавання вуглекислого газу
Отримайте, зберіть, розпізнайте вуглекислий газ і зробіть досліди, що підтверджують його хімічні властивості. Запишіть рівняння відповідних реакцій.Взяли шматок вугілля, розжарили його в полум'ї пальника і опустили його в посудину з киснем, він спалахнув жовто-синім полум'ям.
Варіант 4. Отримання, збирання та розпізнавання етилену
У пробірку, з газовідвідною трубкою, помістили суміш, що складається з однієї частини безводного ацетату натрію і двох частин гідроксиду натрію (безводного). Пробірку закріпили на штативі горизонтально та нагріли. Газ, що виділяється, пропустили в окремі пробірки з бромом і розчином перманганату калію. Розчини не змінюють свого забарвлення. Підпалили газ, що виділяється з трубки, він горить синім полум'ям, що не світиться. У пробірку помістили трохи концентрованої сірчаної кислоти
Практична робота «Розпізнавання органічних речовин».
Ціль:повторити якісні реакції, притаманні органічних речовин, закріпити навички хімічного експерименту.
Реактиви та обладнання:досліджувані речовини (гліцерин, крохмаль, лимонна кислота, глюкоза), вода, аміачний розчин оксиду срібла, сульфат міді, гідроксид натрію, йод, спиртування, сірники, пробірки, тримач для пробірок.
Хід роботи
Завдання №1.Визначте видані вам речовини шляхом якісних реакцій.Оформіть результати та сформулюйте висновки.
| Визначається речовина | Результати якісної реакції |
|
| 1. Гліцерин CH 2 -CH-CH 2 / / / OH OH OH | Cu(OH) 2 | Яскраво-синій розчин гліцерату міді |
| 2.Крахмал (C 6 H 10 O 5 )n | Розчин йоду | Розчин синього кольору |
| 3.Лімонна кислота | а) Універсальний індикатор. Б) Метал В)Na 2CO 3 | A )Універсальний індикатор стає червоним Б) Виділяється газ В)Виділяється газ |
| 4.Глюкоза C 6 H 12 O 6 | Cu(OH) 2 Ag 2 O | Червоний осад Відновлення срібла з оксиду |
Завдання №2.Відповідайте на запропоновані питання.
1.Які речовини утворюються в результаті гідролізу крохмалю?
2.Як довести досвідченим шляхом, що видана вам речовина-це оцтова кислота?
3.Чому сахароза не дає реакцію срібного дзеркала?
Висновки:
«Практична робота №2»
Практична робота
«Реакція іонного обміну. Гідроліз солей»
Мета роботи:закріпити навички складання реакцій іонного обміну, повторити ознаки перебігу реакцій іонного обміну остаточно. Закріпити поняття «гідроліз солей». Досвідченим шляхом досліджувати РН розчинів солей. Закріпити навички хімічного експерименту, повторити правила техніки безпеки.
Хід роботи
Завдання №1.Проведіть експеримент між розчинами електролітів. Позначте явища, що спостерігаються.
А)Na 2 CO 3 та H 2 SO 4 (газ)
Б)BaCl 2 і H 2SO 4 (осад б.ц.)
В)NaOH та CuSO 4 (осад г.ц.)
Г) NaOH та H 2SO 4(вода)
Складіть рівняння у молекулярному та іонному вигляді.
Завдання №2.Гідроліз розчинів солей.
Випробуйте розчини солей універсальним індикатором. Визначте РН розчину солі, середовище зміни кольору універсального індикатора.
Гідроліз розчинів солей.
А) Na 2CO 3
Б) NH 4Cl
В) FeCl 3
Результати оформіть у таблицю.
| Na 2 CO 3 | NH 4 Cl | FeCl 3 |
|
| Заснування | |||
| Універсальний індикатор |
Складіть рівняння реакцій гідролізу та запишіть висновок.
Наведіть своє робоче місце в порядок.
Висновки:
Перегляд вмісту документа
«Практична робота №3»
Практична робота «Якісний аналіз органічних сполук»
Інструкція до роботи
Мета роботи:виробити навички щодо якісного визначення вуглецю, водню та хлору в органічних сполуках
Обладнання, матеріали:парафінова свічка, тримач для пробірок, пробірки, хімічна склянка, мідна спіраль, спиртування, дихлоретан.
Завдання №1 Якісне визначення вуглецю в органічних сполуках.
Засвітіть парафінову свічку. Внесіть чисту пробірку в полум'я свічки. Що ви спостерігаєте? Поясніть результати досвіду.
Завдання №2 Якісне визначення водню в органічних сполуках.Накрийте чистою сухою склянкою свічку, що горить. Що ви спостерігаєте? Поясніть результати досвіду.
Завдання №3 Якісне визначення хлору в органічних сполуках.
Мідну спіраль прожарити на полум'ї спиртівки та внести до хлоропохідного алкану.
Потім знову внести у полум'я спиртування. Що ви спостерігаєте?
Результати дослідів запишіть до таблиці. Сформулюйте та запишіть висновок.
| Що робили? | Що спостерігали? | ||
Представлені розробки практичних робіт для 11 класу
«Практична робота №2 – 11 кл»
Практична робота №2
Ідентифікація неорганічних речовин.
Мета роботи : за допомогою характерних реакцій розпізнати запропоновані
неорганічні речовини, визначити якісний склад ґрунту.
Устаткування :
Реактиви :
Хід роботи :
Приготувати таблицю для запису виконання роботи за формою:
| Що робили | Спостереження | Рівняння реакцій | |
2. Виконати досліди
3. Заповнити таблицю.
4. Зробити загальний висновок.
Правила техніки безпеки
Працювати з кислотами та лугами обережно. Концентровані кислоти акуратно вносити у пробірку над лотком. Якщо кислота потрапила на шкіру чи одяг, швидко змити велику кількість води.
Нічого не куштувати на смак.
У пробірку наливати трохи більше 1 мл речовин.
Нюхати леткі речовини обережно, спрямовуючи повітря рукою від пробірки до себе.
Не закривати пробірку пальцем при збовтуванні рідини. Збовтувати вміст слід тримаючи пробірку за верхню частину і злегка похитуючи.
Не нахилятися над пробіркою, тому що бризки можуть потрапити у вічі.
Пробірку з рідиною, що нагрівається, тримати отвором у бік від себе і від товаришів, так як рідина іноді може виплеснутися з пробірки.
При нагріванні пробірки не торкатися гніт спиртування, так як гніт холодний і пробірка може луснути.
Гаряче спиртування не можна переносити зі столу на стіл.
Запалювати спиртування тільки сірниками.
Гасити спиртування тільки ковпачком.
Після роботи упорядкувати своє робоче місце.
Досвід. Якісні реакції на неорганічні речовини.
Завдання: у трьох пронумерованих пробірках (1, 2, 3) дано речовини:
ХЛОРИД АМОНІЮ
СОЛЯНА КИСЛОТА
СУЛЬФАТ НАТРІЮ
За допомогою характерних реакцій розпізнати, в якій із пробірок є дані речовини.
Для виконання цього досвіду, вміст кожної пронумерованої пробірки розділити на три проби.
1. Для визначення хлориду амонію – у пробірку з хлоридом амонію долити розчин гідроксиду натрію, нагріти в полум'ї спиртування.
Що спостерігаєте?
2. Для визначення соляної кислоти – в пробірку із соляною кислотою долити розчин нітрату срібла.
Що спостерігаєте?
Написати рівняння реакції у молекулярній, повній іонній, скороченій іонній формах.
3. Для визначення сульфату натрію - в пробірку із сульфатом натрію долити розчин хлориду барію.
Що спостерігаєте?
4. Написати рівняння реакції у молекулярній, повній іонній, скороченій іонній формах.
Перегляд вмісту документа
«Практична робота №1-1»
Практична робота №1
Мета роботи :
Обладнання та реактиви:прилад для отримання газів, пробірки (2 шт.), штатив для пробірок, шпатель, хімічний стакан, лучинка, сірники, мармур (СаСО 3), вапняна вода (Са(ОН) 2), HCl (1:2).

Техніка безпеки: 


Хід роботи :
| Дії | Спостереження | Рівняння реакцій. Висновки |
| Одержання вуглекислого газу  | CaCO 3 + HCl → |
|
|
Перенесіть кінець газовідвідної трубки в пробірку з 1 мл вапняної води та пропускайте вуглекислий газ. Запишіть рівняння відповідних реакцій. | Ca(OH) 2 + CO 2 → |
Висновок :
Перегляд вмісту документа
«Практична робота №1-2»
Практична робота №1
«Отримання, збирання та розпізнавання газів»
Мета роботи :
Обладнання та реактивиКабіна: пробірки (3 шт.), спиртовка, сірники, штатив, газовідвідна трубка, хлорид амонію (кристалічний), гідроксид кальцію (кристалічний), стаканчик з водою, індикаторний папір, вата.


Техніка безпеки
: 




Хід роботи :
| Дії | Спостереження | Рівняння реакцій. Висновки |
|
| NH 4 Cl + Ca (OH ) 2 → NH 4 OH↔ |
Висновок :
Перегляд вмісту документа
«Практична робота №1-3»
Практична робота №1
«Отримання, збирання та розпізнавання газів»
Мета роботи :
Обладнання та реактиви:пробірки (2 шт.), штатив для пробірок, шпатель, лучинка, сірники, перманганат калію (KMnO 4), індикаторний папір.





Техніка безпеки: 
Хід роботи :
| Дії | Спостереження | Рівняння реакцій. Висновки |
| Отримання кисню Одержання кисню.  | KMnO 4 → |
|
| Збирання та розпізнавання вуглекислого газу Наповнювати газом пробірку протягом 1 хв. Внести палаючу лучинку в склянку. Спостерігати зміни. | CxHy+O 2 → |
Висновок :
Перегляд вмісту документа
«Практична робота №1»
Практична робота №1.
«Отримання, збирання та розпізнавання газів».
Цілі уроку:перевірити правильність засвоєння знань про газоподібні речовини, способи їх отримання та розпізнавання; продовжити формувати вміння проводити експеримент, спостерігати та робити висновки з побаченого.
Обладнання:комп'ютер, презентація уроку, пробірки, спиртування, сірники, лучинки, скляні трубки; розчини: соляної кислоти, оцтової кислоти, пероксиду водню, вапняної води; цинк, мармур,
Хід уроку.
I. Підготовка до уроку(Перевірити готовність до уроку груп учнів, обладнання, класу; відзначити в журналі відсутніх учнів; повідомити тему та цілі уроку).
ІІ. Інструктаж з техніки безпеки.
1. Який вплив на шкіру людини та тканину чинять кислоти? (При попаданні на шкіру людини або тканину кислоти руйнують їх).
2. Який вплив на шкіру людини та тканину чинять луги? (При попаданні на шкіру людини або тканину, луги руйнують їх).
3. Отже, як необхідно поводитися з кислотами та лугами? (Кислоти та луги необхідно брати трубкою і лише у потрібній кількості).
4. Від чиєї спиртівки можна запалити свою? (Спиртівку не можна запалювати від іншого спиртування. Її можна запалювати тільки сірником).
Нагадую, що поводитися зі скляним посудом потрібно дуже обережно, щоб не розчавити чи розбити його. Сколи при руйнуванні скляного посуду є дуже гострими і можуть викликати дуже глибокі порізи.
ІІІ. Інструктаж роботи.
Практичну роботу ви виконуватимете за інструкцією.
Відповідно до вашого варіанта, дайте назву практичної роботі, сформулюйте мету, визначте обладнання та реактиви. При оформленні роботи обов'язково описуєте свої дії та спостереження, записуєте рівняння хімічних реакцій, робите малюнок установки для отримання зазначеного газу, записуєте висновок по роботі.
Після закінчення роботи навести лад на робочому місці.
IV. Виконання роботи.
«Отримання, збирання та розпізнавання кисню».
«Отримання, збирання та розпізнавання вуглекислого газу».
«Отримання аміаку»
Повторіть правила безпечної роботи із лугами. Дотримуйтесь цих правил у процесі проведення хімічного експерименту.
Отримання, збирання та розпізнавання аміаку
1) Помістіть у ступку по дві ложки-дозатора хлорид амонію та гідроксиду кальцію кожного. Розітріть суміш маточкою. Що відчуваєте?
2) Зберіть прилад для одержання аміаку: наберіть у суху пробірку не більше ¼ її висоти приготовленої суміші, закрийте пробірку пробкою з газовідвідною трубкою, зміцніть пробірку в лапці штатива з невеликим нахилом до пробки. Надягніть суху пробірку для збирання аміаку на газовідвідну трубку, спрямовану вгору. 
3) Нагрівайте пробірку із сумішшю.
4) Піднесіть вологий індикаторний папірець до отвору пробірки з аміаком. 
5) Припиніть нагрівання. Зніміть пробірку з аміаком, не перевертаючи її, опустіть отвором вниз у склянку з водою. Закрийте кінець газовідвідної трубки вологим тампоном.
Перегляд вмісту документа
«Практичні роботи 11 клас обладнання та реактиви»
Практичні роботи 11 клас
| Назва роботи | Обладнання та реактиви |
|
| Отримання та розпізнавання газів | Обладнання:штатив з пробірками, спиртування, сірники, лучинки, скляні газовідвідні трубки, вата, шпатель. Реактиви:розчини: соляної кислоти, оцтової кислоти, пероксиду водню, вапняної води; цинк, мармур., хлорид амонію, гідроксид кальцію кристалічний, індикаторний папір, перманганат калію. |
|
| Ідентифікація неорганічних речовин | Устаткування : штатив з пробірками, спиртування, сірники, тримач для пробірок. Реактиви : розчини: хлориду амонію, сульфату натрію, гідроксиду натрію, хлориду барію, соляної кислоти; синій лакмусовий папір, цинк, нітрат срібла. |


